وساطه
Catalysis - Catalyse
الوساطة
الوسيط (أو الحفّاز) catalyst في الكيمياء مادة تغيِّر من سرعة التفاعل الكيمياوي زيادة أو نقصاناً، ولكنها تبقى من دون تغير كيمياوي في نهاية التفاعل، ويتضمن هذا التعريف في معناه أن مقدار الحفاز يبقى ذاته قبل التفاعل وبعده. ويستخدم الحفّاز المرة تلو الأخرى، لأن مفعوله سريع فلا يحتاج إلا إلى كميات ضئيلة منه لتسريع التفاعل.
ويدرج في الجدول (1) بعض الأمثلة على تفاعلات كيمياوية والحفّازات المستخدمة فيها.
كيفية تأثير الحفّاز في سرعة التفاعل
حتى يحدث التفاعل بين المتفاعلات لا يكفي اصطدامها بعضها ببعض فحسب، بل ينبغي إلى جانب ذلك أن تصطدم بحد أدنى من الطاقة يساوي أو يزيد على مقدار محدد يأخذ اسماً خاصاً هو طاقة تنشيط التفاعل Ea.
ويمكن تعيين طاقة التنشيط على مخطط توزع ماكسويل بولتزمان كما في المخطط البياني (1).
وهكذا فإن تلك الجسيمات الممثلة بالمساحة إلى يمين طاقة التنشيط هي فقط التي تتفاعل في الاصطدام. أما القسم الأعظم من الجسيمات فإنها لا تمتلك ما يكفي من الطاقة وسترتد بعد الاصطدام من دون تفاعل.
فلكي تزداد سرعة التفاعل يلزم العمل على زيادة عدد الاصطدامات الناجحة. وإحدى طرائق تحقيق ذلك تقوم على توفير طريقة (آلية) بديلة لحدوث التفاعل ذات طاقة تنشيط أدنى ويمثل ذلك بإزاحة طاقة التنشيط كما هو موضح في المخطط البياني (2).
تؤدي إضافة الحفّاز إلى توفير مسار بديل للتفاعل، تكون طاقة التنشيط فيه أدنى، كما هو مبين في المخطط البياني (3).
فليس عمل الحفّاز خفض طاقة التنشيط بل توفير مسار بديل للتفاعل بطاقة تنشيط أدنى.
أنواع الحفاز
تصنف الحفّازات ( الوسطاء) في نوعين رئيسين: حفازات غير متجانسة وأخرى متجانسة. ويكون الحفاز في النوع الأول طوراًphase مختلفاً عن المتفاعلات reactants؛ أما في الحفز المتجانس فيوجد الحفاز والمتفاعلات معاً في الطور نفسه.
ـ الحفازات غير المتجانسة
في الحفز غير المتجانس يستعمل حفاز في طور مختلف عن المتفاعلات، مثلاً يستعمل حفاز صلب في تماس مع المتفاعلات التي تكون إما سائلة وإما غازية. ويتضمن عمل الحفاز الخطوات الأساسية الآتية:
يمتَزّ adsorb الحفّاز واحداً أو أكثر من المتفاعلات على سطحه في مواضع محددة تسمى المراكز الفعالة active sites، وليس الامتزاز إلا التصاق المادة على السطح بخلاف الامتصاص absoption الذي تُشتمل فيه المادة ضمن بنية مادة أخرى. أما المركز الفعّال فهو جزء من السطح قادر على امتزاز المادة ومن ثمَّ جعلها تتفاعل.
ويحدث نوع من التآثر (التفاعل المتبادل) interaction بين سطح الحفاز والمتفاعلات ما يجعلها أكثر قدرة على التفاعل، وذلك إما بقيام السطح بالتفاعل معها وإما بإضعاف الروابط في جزيئات المتفاعلات الممتزة على سطح الحفّاز.
وهكذا يحصل التفاعل وترتبط في هذه المرحلة جزيئات المتفاعلات جميعاً بالسطح أو يرتبط بالسطح نوع واحد على الأقل ويقوم النوع الآخر من جزيئات المتفاعلات الحرة في الطور الغازي أو السائل بالاصطدام بها والتفاعل معها.
ويتصف الحفاز الجيد بأنه يمتز جزيئات المتفاعل بقوة تكفي لقيامها بالتفاعل، ولكن ليس بقوة زائدة تصبح معه جزيئات المنتج شديدة الارتباط بالسطح على نحو شبه دائم.
فالفضة مثلاً لا تعد حفازاً جيداً لأنها لا تستطيع ربط جزيئات المتفاعل بقوة كافية، ومعدن التنغستن لا يكون حفازاً جيداً لأنه يمتز بقوة زائدة.
أما المعادن مثل البلاتين والبالاديوم والنيكل فهي حفازات جيدة لأنها تمتز المتفاعلات بقوة كافية وتمسك بها وتنشطها، ولكن ليس بقوة زائدة تمنع انفلات المنتجات من السطح.
أمثلة الحفز غير المتجانس
1ـ هدرجة الرابطة المضاعفة −C =C-
لعل أبسط أمثلة هذا التفاعل ذلك الذي يجري في تفاعل الإيتين والهدروجين بوجود حفاز من النيكل.
ولعل هذا التفاعل عديم الجدوى من الناحية العملية، إذ يتحول فيه الإيتين ـ المادة الكبيرة الفائدة ـ إلى الإيتان عديم الفائدة نسبياً، غير أن التفاعل نفسه يحدث مع أي مادة عضوية تحتوي على الرابطة المضاعفة −C =C- [ر: الهدرجة] ولعل من أهم تطبيقات هذا التفاعل هدرجة الزيوت النباتية لصناعة المرغرين.
تمتز في هذا التفاعل جزيئات الإيتين على سطح النيكل إذ تنكسر الرابطة بين ذرات الكربون وتقوم الإلكترونات بربط الذرات بسطح النيكل كما في الشكل (1).
وتمتز على سطح النيكل جزيئات الهدروجين التي تنقسم إلى ذرات يمكنها التجول على سطح النيكل كما في الشكل (2).
وإذا قيض لذرة الهدروجين الانتشار مقتربة من إحدى ذرات الكربون المرتبطة، تنقلب الرابطة بين الكربون إلى رابطة بين الكربون والهدروجين الشكل (3).
وينفلت عندها هذا الطرف من جزيء الإيتين من السطح ويعقب ذلك حدوث الشيء ذاته للطرف الآخر من الجزيء الشكل (4).
وكما في السابق تكوّن إحدى ذرات الهدروجين رابطة مع الكربون مع انفلات هذا الطرف أيضاً من السطح. وهكذا يصبح سطح النيكل جاهزاً من جديد لاستقبال جزيء متفاعِل آخر الشكل (5).
2ـ المحولات الحفزية
يقوم هذا النوع من الحفازات بتغيير الجزيئات السامة مثل CO وأنواع أكاسيد النتروجين في عوادم السيارات إلى جزيئات غير مؤذية مثل CO2 و N2 وذلك باستخدام حفازات غير متجانسة مثل البلاتين والبالاديوم والروديوم.
ترسَّب هذه المعادن على شكل طبقات رقيقة على حامل من السيراميك مما يجعل مساحة سطح الحفاز أعظمياً وبالتالي استخدام مقدار أصغري منه. ففي تفاعل CO مع أحادي أكسيد النتروجين ـ على سبيل المثال ـ يمتز كل من أحادي أكسيد الكربون وأحادي أكسيد النتروجين ـ كما في المثال السابق ـ على سطح الحفّاز ليتفاعلا متحولين إلى ثنائي أكسيد الكربون CO2 وآزوت (نتروجين) N2.
3 ـ استخدام أكسيد الفاناديوم V2O5 في اصطناع حمض الكبريت بطريقة التماس.
يحوَّل ثنائي أكسيد الكبريت في هذه الطريقة إلى ثلاثي أكسيد بإمرار SO2 والأكسجين على سطح حفّاز من أكسيد الفاناديوم:
ويختلف عمل الحفّاز هنا عنه في الأمثلة السابقة بأن الغازات تتفاعل في الواقع على الحفّاز وتؤدي إلى تغييره مؤقتاً، ويوضح هذا المثال مقدرة المعادن الانتقالية ومركباتها على الحفز بسبب مقدرتها على تغيير حالة أكسدتها. يتأكسد ثنائي أكسيد الكبريت إلى ثلاثي أكسيد الكبريت بوساطة أكسيد الفاناديوم V2O5 ويختَزَل أكسيد الفاناديوم (V) في هذه العملية إلى أكسيد الفاناديوم (I V):
ثمَّ يتأكسد V2O4 بالأكسجين متحولاً إلى V2O5 من جديد.
وهكذا يعود الحفّاز في نهاية التفاعل كيمياوياً إلى الحال التي كان عليها قبل التفاعل.
الحفازات المتجانسة
يكون الحفّاز في هذا النوع في الطور نفسه الذي توجد فيه المتفاعلات، إذ يكون الجميع إما في طور واحد غازي وإما سائل، ويدرج فيما يلي بعض الأمثلة على هذا النوع من الحفز.
1ـ تفاعل أيون (شاردة) البرسلفات مع أيون اليوديد: وهو مثال على التفاعل الحفزي المتجانس في الطور السائل.
يعد أيون البرسلفات -S2O82 عاملاً مؤكسداً قوياً في حين يعدّ أيون اليوديد - I عاملاً مرجعاً يتأكسد بسهولة بأيون البرسلفات، إلا أن التفاعل يجري في الطور المائي ببطء واضح بين هذين النوعين من الأيونات. ويتضح السبب عند النظر في المعادلة:
إذ يحتاج التفاعل إلى حدوث الاصطدام بين أيونين كلاهما سالب. يستخدم لتسريع هذا التفاعل حفّاز من الحديد (II) أو الحديد (III) يضاف إلى محلول التفاعل. ويدل استخدام الحديد هنا وهو معدن انتقالي على مقدرة هذا النوع من المواد على الوساطة (الحفز) بسبب مقدرتها على تغيير حالة أكسدتها. فإذا استخدم حفّاز من الحديد (II) يقوم أيون البرسلفات بأكسدة الحديد (II) إلى الحديد (III) ويرجَع أيون البرسلفات في هذا التفاعل إلى أيون الكبريتات
ويعد أيون الحديد (III) مؤكسِداً قوياً يستطيع أكسدة أيون اليوديد إلى اليود، ويرجَع الحديد (III) إلى الحديد (II) مرة ثانية:
وفي كلتا العمليتين يتضمن التفاعل اصطداماً بين أيونات سالبة وأخرى موجبة الأمر الذي يعد أسهل منه في الاصطدام بين أيونين كلاهما سالب في التفاعل من دون حفاز.
ويحدث التفاعل نفسه ـ ولكن بترتيب مختلف ـ عندما يستخدم حفّاز من (Fe(III بدلاً من (Fe(II.
2ـ تخريب أوزون الجو
يعد هذا مثال التفاعلات المؤذية للبيئة إذ توجد المتفاعلات والحفاز والمنتجات جميعاً في طور غازي واحد.
يتكون الأوزون O3 ويتفكك على الدوام في الجو العالي بتأثير الأشعة فوق البنفسجية. تمتص جزيئات الأكسجين العادي الأشعة فوق البنفسجية وتنقسم إلى ذرات الأكسجين التي تمتلك الكترونات عازبة. وتسمى هذه الذرات جذوراً حرة free radicals وتتصف بأنها شديدة الفعالية. وتتحد الآن جذور الأكسجين مع جزيئات الأكسجين العادية مكونة الأوزون.
كذلك يمكن للأوزون أن ينفصم معطياً الأكسجين العادي وجذور الأكسجين وذلك بامتصاصه الأشعة فوق البنفسجية:
ويمضي تكون الأوزون وانفصامه على نحو مستمر، الأمر الذي يسهم في منع قدر كبير من الإشعاع فوق البنفسجي الضار من الوصول إلى سطح الأرض.
ويأتي الإنسان بنشاطاته المتنوعة على سطح الأرض «والمؤذية» في كثير منها ليخرب الأوزون الذي يكون في العادة طبقة جد رقيقة تحيط بالكرة الأرضية. وبالتالي يمنعه من امتصاص الأشعة فوق البنفسجية. يطلق الإنسان إلى الجو نوعاً من المركبات الكيمياوية المسماة كلورو فلورو كربون (ومثالهاCF2Cl2) التي تستخدم في الحلالات الهوائية (إيروسولات) aerosols ومواد انجماد. تتفكك هذه المركبات ببطء في الجو و تطلق ذرات الكلور، أي جذور الكلور الحرة التي تحفز تخريب الأوزون، ويحدث ذلك وفق مرحلتين: ينقسم في أولاها الأوزون ويتكون جذر حر جديد:
ويعاد تكوين الحفّاز Cl بتفاعل ثانٍ بين الجذر الحر ClO وذرة O التي سبق بيان كيفية تكونها.
ويستمر جذر الكلور في أداء مهمته التخريبية بحيث يمكن لكل جذر كلور أن يخرب بضعة آلاف من جزيئات الأوزون.
3ـ الحفز الذاتي
أكسدة حمض الحمّاض بأيونات فوق المنغنات (المنغنيز هنا بدرجة أكسدة +7).
يُحفَّز التفاعل في هذه الحالة بواحد من منتجاته ولعل أكسدة محلول حمض الحماض بمحلول محمض من منغنات (VII) البوتاسيوم (المعروفة باسم فوق منغنات البوتاسيوم) مثال بسيط على الحفز الذاتي:
يتصف هذا التفاعل بأنه شديد البطء عند درجة الحرارة العادية ويستخدم في المعايرة الحجمية لتعيين تركيز محلول منغنات (VII) البوتاسيوم ويجري عادة عند درجة حرارة قريبة من 60 ْس ومع ذلك فهو تفاعل بطيء ولاسيما في بدايته.
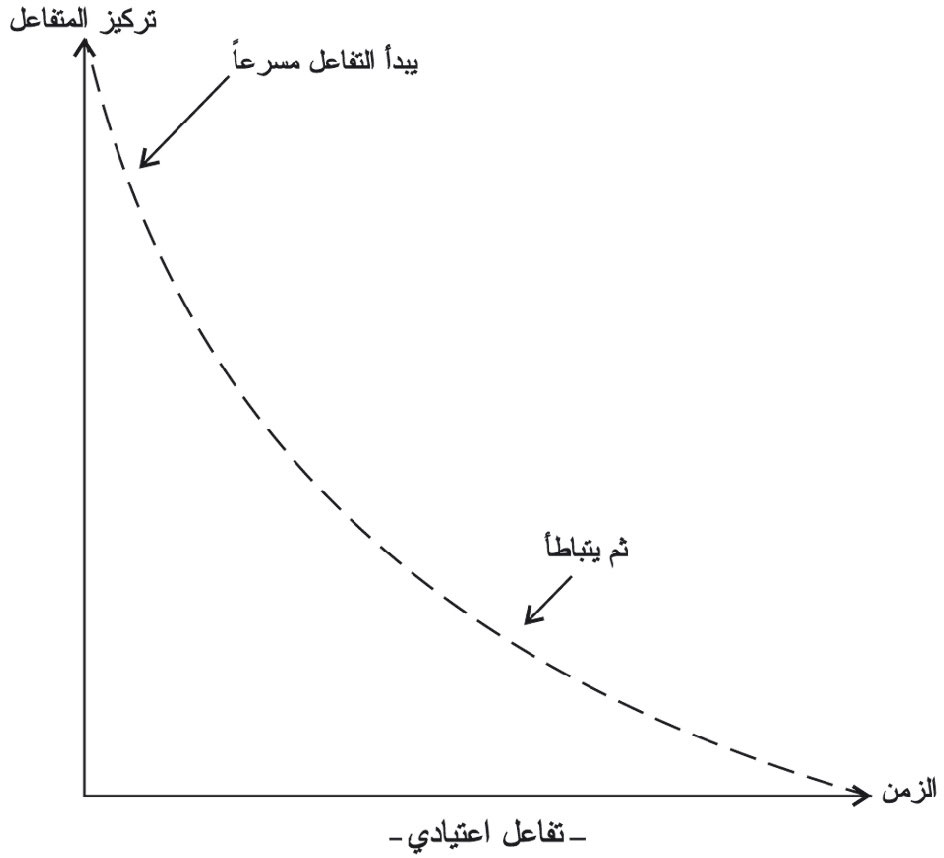
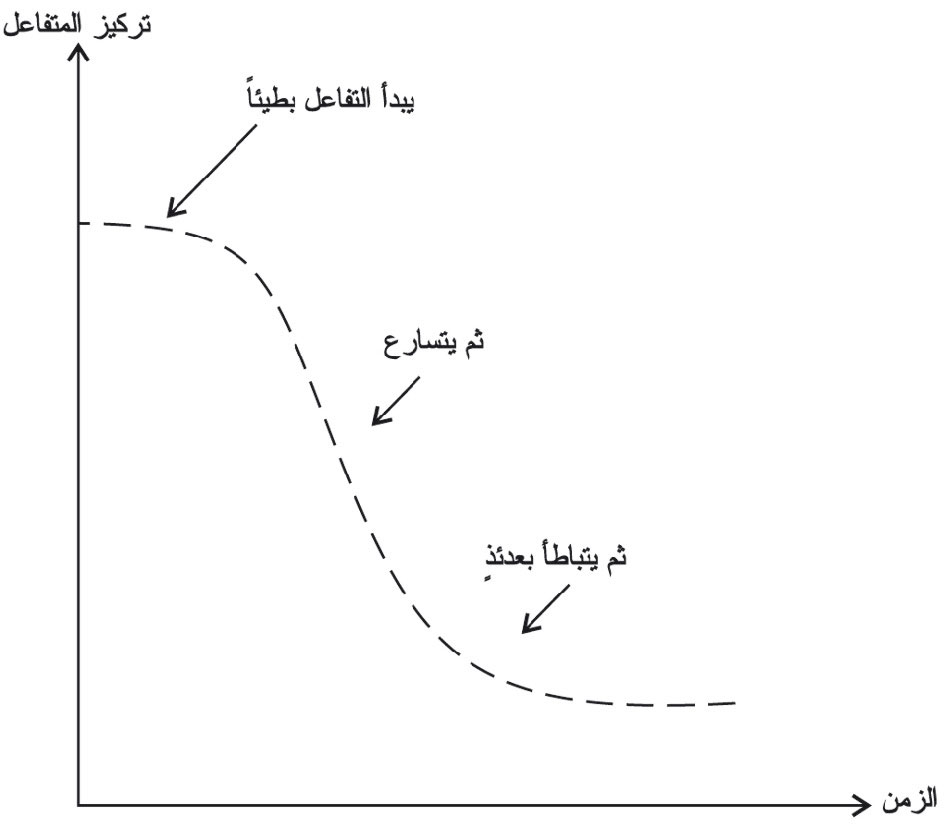
يحفَّز التفاعل بأيونات المنغنير (II) ولأنها ليست موجودة قبل بدء التفاعل لذلك ينطلق بسرعة جد منخفضة عند درجة الحرارة العادية ولكن تركيز أيونات المنغنير (II) يزداد مع استمرار التفاعل مما يدفع به للتسارع. ويمكن تمثيل هذا التأثير برسم تركيز أحد المتفاعلات بدلالة الزمن كما هو مبيَّن في المخطط البياني (4).
يبدو التفاعل بطيئاً في البدء (تفاعل غير محفَّز) ثمَّ يتسارع التفاعل مع تكون الحفاز (+Mn2) ثمَّ يتباطأ التفاعل لتناقص تراكيز المتفاعلات في النهاية.
ويختلف هذا الشكل عن المخطط البياني (5) الممثل لسرعة التفاعل الاعتياد
حسن كلاوي
Catalysis - Catalyse
الوساطة
الوسيط (أو الحفّاز) catalyst في الكيمياء مادة تغيِّر من سرعة التفاعل الكيمياوي زيادة أو نقصاناً، ولكنها تبقى من دون تغير كيمياوي في نهاية التفاعل، ويتضمن هذا التعريف في معناه أن مقدار الحفاز يبقى ذاته قبل التفاعل وبعده. ويستخدم الحفّاز المرة تلو الأخرى، لأن مفعوله سريع فلا يحتاج إلا إلى كميات ضئيلة منه لتسريع التفاعل.
|
||||||||||||||
كيفية تأثير الحفّاز في سرعة التفاعل
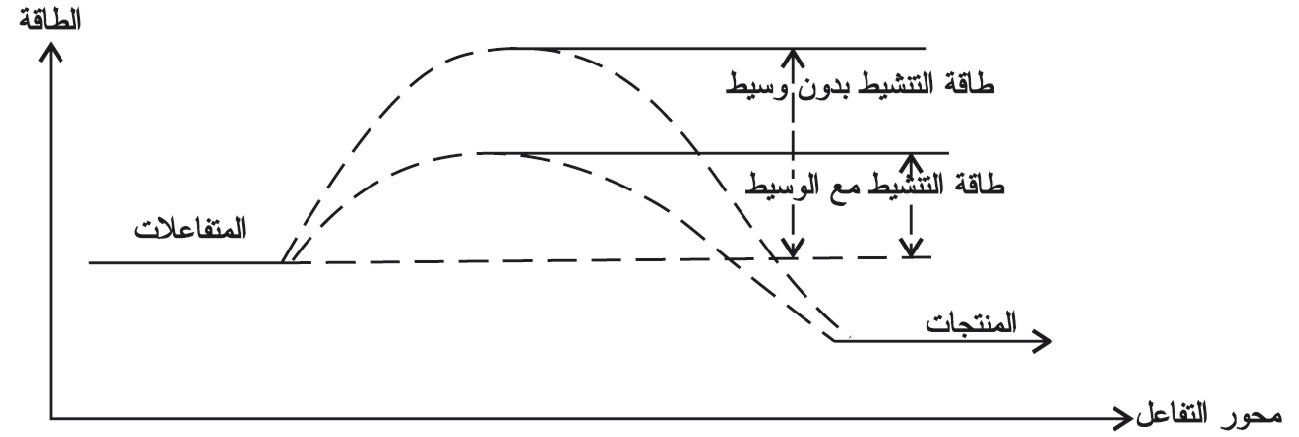
حتى يحدث التفاعل بين المتفاعلات لا يكفي اصطدامها بعضها ببعض فحسب، بل ينبغي إلى جانب ذلك أن تصطدم بحد أدنى من الطاقة يساوي أو يزيد على مقدار محدد يأخذ اسماً خاصاً هو طاقة تنشيط التفاعل Ea.
ويمكن تعيين طاقة التنشيط على مخطط توزع ماكسويل بولتزمان كما في المخطط البياني (1).
 |
| المخطط (1) |
 |
| المخطط (2) |
 |
| المخطط (3) |
فلكي تزداد سرعة التفاعل يلزم العمل على زيادة عدد الاصطدامات الناجحة. وإحدى طرائق تحقيق ذلك تقوم على توفير طريقة (آلية) بديلة لحدوث التفاعل ذات طاقة تنشيط أدنى ويمثل ذلك بإزاحة طاقة التنشيط كما هو موضح في المخطط البياني (2).
تؤدي إضافة الحفّاز إلى توفير مسار بديل للتفاعل، تكون طاقة التنشيط فيه أدنى، كما هو مبين في المخطط البياني (3).
فليس عمل الحفّاز خفض طاقة التنشيط بل توفير مسار بديل للتفاعل بطاقة تنشيط أدنى.
أنواع الحفاز
تصنف الحفّازات ( الوسطاء) في نوعين رئيسين: حفازات غير متجانسة وأخرى متجانسة. ويكون الحفاز في النوع الأول طوراًphase مختلفاً عن المتفاعلات reactants؛ أما في الحفز المتجانس فيوجد الحفاز والمتفاعلات معاً في الطور نفسه.
ـ الحفازات غير المتجانسة
في الحفز غير المتجانس يستعمل حفاز في طور مختلف عن المتفاعلات، مثلاً يستعمل حفاز صلب في تماس مع المتفاعلات التي تكون إما سائلة وإما غازية. ويتضمن عمل الحفاز الخطوات الأساسية الآتية:
يمتَزّ adsorb الحفّاز واحداً أو أكثر من المتفاعلات على سطحه في مواضع محددة تسمى المراكز الفعالة active sites، وليس الامتزاز إلا التصاق المادة على السطح بخلاف الامتصاص absoption الذي تُشتمل فيه المادة ضمن بنية مادة أخرى. أما المركز الفعّال فهو جزء من السطح قادر على امتزاز المادة ومن ثمَّ جعلها تتفاعل.
ويحدث نوع من التآثر (التفاعل المتبادل) interaction بين سطح الحفاز والمتفاعلات ما يجعلها أكثر قدرة على التفاعل، وذلك إما بقيام السطح بالتفاعل معها وإما بإضعاف الروابط في جزيئات المتفاعلات الممتزة على سطح الحفّاز.
وهكذا يحصل التفاعل وترتبط في هذه المرحلة جزيئات المتفاعلات جميعاً بالسطح أو يرتبط بالسطح نوع واحد على الأقل ويقوم النوع الآخر من جزيئات المتفاعلات الحرة في الطور الغازي أو السائل بالاصطدام بها والتفاعل معها.
ويتصف الحفاز الجيد بأنه يمتز جزيئات المتفاعل بقوة تكفي لقيامها بالتفاعل، ولكن ليس بقوة زائدة تصبح معه جزيئات المنتج شديدة الارتباط بالسطح على نحو شبه دائم.
فالفضة مثلاً لا تعد حفازاً جيداً لأنها لا تستطيع ربط جزيئات المتفاعل بقوة كافية، ومعدن التنغستن لا يكون حفازاً جيداً لأنه يمتز بقوة زائدة.
أما المعادن مثل البلاتين والبالاديوم والنيكل فهي حفازات جيدة لأنها تمتز المتفاعلات بقوة كافية وتمسك بها وتنشطها، ولكن ليس بقوة زائدة تمنع انفلات المنتجات من السطح.
أمثلة الحفز غير المتجانس
1ـ هدرجة الرابطة المضاعفة −C =C-
لعل أبسط أمثلة هذا التفاعل ذلك الذي يجري في تفاعل الإيتين والهدروجين بوجود حفاز من النيكل.
 |
 |
| الشكل (1) |
 |
| الشكل (2) |
 |
| الشكل (3) |
 |
| الشكل (4) |
 |
| الشكل (5) |
تمتز في هذا التفاعل جزيئات الإيتين على سطح النيكل إذ تنكسر الرابطة بين ذرات الكربون وتقوم الإلكترونات بربط الذرات بسطح النيكل كما في الشكل (1).
وتمتز على سطح النيكل جزيئات الهدروجين التي تنقسم إلى ذرات يمكنها التجول على سطح النيكل كما في الشكل (2).
وإذا قيض لذرة الهدروجين الانتشار مقتربة من إحدى ذرات الكربون المرتبطة، تنقلب الرابطة بين الكربون إلى رابطة بين الكربون والهدروجين الشكل (3).
وينفلت عندها هذا الطرف من جزيء الإيتين من السطح ويعقب ذلك حدوث الشيء ذاته للطرف الآخر من الجزيء الشكل (4).
وكما في السابق تكوّن إحدى ذرات الهدروجين رابطة مع الكربون مع انفلات هذا الطرف أيضاً من السطح. وهكذا يصبح سطح النيكل جاهزاً من جديد لاستقبال جزيء متفاعِل آخر الشكل (5).
2ـ المحولات الحفزية
يقوم هذا النوع من الحفازات بتغيير الجزيئات السامة مثل CO وأنواع أكاسيد النتروجين في عوادم السيارات إلى جزيئات غير مؤذية مثل CO2 و N2 وذلك باستخدام حفازات غير متجانسة مثل البلاتين والبالاديوم والروديوم.
ترسَّب هذه المعادن على شكل طبقات رقيقة على حامل من السيراميك مما يجعل مساحة سطح الحفاز أعظمياً وبالتالي استخدام مقدار أصغري منه. ففي تفاعل CO مع أحادي أكسيد النتروجين ـ على سبيل المثال ـ يمتز كل من أحادي أكسيد الكربون وأحادي أكسيد النتروجين ـ كما في المثال السابق ـ على سطح الحفّاز ليتفاعلا متحولين إلى ثنائي أكسيد الكربون CO2 وآزوت (نتروجين) N2.
3 ـ استخدام أكسيد الفاناديوم V2O5 في اصطناع حمض الكبريت بطريقة التماس.
يحوَّل ثنائي أكسيد الكبريت في هذه الطريقة إلى ثلاثي أكسيد بإمرار SO2 والأكسجين على سطح حفّاز من أكسيد الفاناديوم:
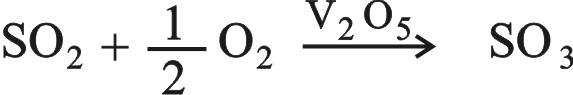 |
 |
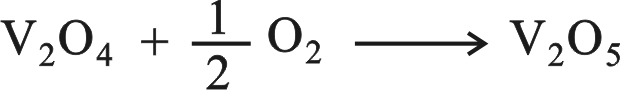 |
الحفازات المتجانسة
يكون الحفّاز في هذا النوع في الطور نفسه الذي توجد فيه المتفاعلات، إذ يكون الجميع إما في طور واحد غازي وإما سائل، ويدرج فيما يلي بعض الأمثلة على هذا النوع من الحفز.
1ـ تفاعل أيون (شاردة) البرسلفات مع أيون اليوديد: وهو مثال على التفاعل الحفزي المتجانس في الطور السائل.
يعد أيون البرسلفات -S2O82 عاملاً مؤكسداً قوياً في حين يعدّ أيون اليوديد - I عاملاً مرجعاً يتأكسد بسهولة بأيون البرسلفات، إلا أن التفاعل يجري في الطور المائي ببطء واضح بين هذين النوعين من الأيونات. ويتضح السبب عند النظر في المعادلة:
 |
 |
 |
ويحدث التفاعل نفسه ـ ولكن بترتيب مختلف ـ عندما يستخدم حفّاز من (Fe(III بدلاً من (Fe(II.
2ـ تخريب أوزون الجو
يعد هذا مثال التفاعلات المؤذية للبيئة إذ توجد المتفاعلات والحفاز والمنتجات جميعاً في طور غازي واحد.
يتكون الأوزون O3 ويتفكك على الدوام في الجو العالي بتأثير الأشعة فوق البنفسجية. تمتص جزيئات الأكسجين العادي الأشعة فوق البنفسجية وتنقسم إلى ذرات الأكسجين التي تمتلك الكترونات عازبة. وتسمى هذه الذرات جذوراً حرة free radicals وتتصف بأنها شديدة الفعالية. وتتحد الآن جذور الأكسجين مع جزيئات الأكسجين العادية مكونة الأوزون.
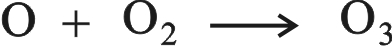 |
 |
ويأتي الإنسان بنشاطاته المتنوعة على سطح الأرض «والمؤذية» في كثير منها ليخرب الأوزون الذي يكون في العادة طبقة جد رقيقة تحيط بالكرة الأرضية. وبالتالي يمنعه من امتصاص الأشعة فوق البنفسجية. يطلق الإنسان إلى الجو نوعاً من المركبات الكيمياوية المسماة كلورو فلورو كربون (ومثالهاCF2Cl2) التي تستخدم في الحلالات الهوائية (إيروسولات) aerosols ومواد انجماد. تتفكك هذه المركبات ببطء في الجو و تطلق ذرات الكلور، أي جذور الكلور الحرة التي تحفز تخريب الأوزون، ويحدث ذلك وفق مرحلتين: ينقسم في أولاها الأوزون ويتكون جذر حر جديد:
 |
 |
3ـ الحفز الذاتي
أكسدة حمض الحمّاض بأيونات فوق المنغنات (المنغنيز هنا بدرجة أكسدة +7).
يُحفَّز التفاعل في هذه الحالة بواحد من منتجاته ولعل أكسدة محلول حمض الحماض بمحلول محمض من منغنات (VII) البوتاسيوم (المعروفة باسم فوق منغنات البوتاسيوم) مثال بسيط على الحفز الذاتي:
 |
يحفَّز التفاعل بأيونات المنغنير (II) ولأنها ليست موجودة قبل بدء التفاعل لذلك ينطلق بسرعة جد منخفضة عند درجة الحرارة العادية ولكن تركيز أيونات المنغنير (II) يزداد مع استمرار التفاعل مما يدفع به للتسارع. ويمكن تمثيل هذا التأثير برسم تركيز أحد المتفاعلات بدلالة الزمن كما هو مبيَّن في المخطط البياني (4).
 |
 |
| المخطط (4) | المخطط (5) |
ويختلف هذا الشكل عن المخطط البياني (5) الممثل لسرعة التفاعل الاعتياد
حسن كلاوي
